Una proteína de ratón poco conocida altera los cambios químicos que provocan cáncer en los genes asociados con las células del cáncer colorrectal humano y potencialmente podría usarse para tratar tumores sólidos, según un nuevo estudio de investigadores del Centro de Cáncer Kimmel de Johns Hopkins y la Academia China de Ciencias.
En el estudio, publicado en Nature Communications , la versión de ratón de la proteína, llamada STELLA, alteró un factor epigenético clave y perjudicó el crecimiento del tumor mejor que la versión humana de la proteína.
Al identificar los aminoácidos (componentes básicos de una proteína) responsables de la diferencia en la actividad, el equipo de investigación desarrolló y probó una estrategia farmacológica que utiliza esos aminoácidos para tratar el cáncer colorrectal en líneas celulares y en un modelo de cáncer en ratones. La epigenética se refiere a las alteraciones químicas de los genes que promueven el crecimiento y la propagación del cáncer sin mutar el ADN.
«En el caso de los tumores sólidos, las principales causas de muerte en el cáncer, existe una enorme necesidad insatisfecha de desarrollar nuevos enfoques para bloquear terapéuticamente las anomalías de metilación del ADN», afirmó el coautor correspondiente Stephen Baylin, profesor de Oncología y Medicina Virginia y DK Ludwig en Johns Hopkins y codirector del Programa de Genética y Epigenética del Centro Oncológico Kimmel de Johns Hopkins.
«Este es un enfoque novedoso para abordar de una manera muy palpable la necesidad emergente de terapia epigenética en el cáncer», añadió el coautor correspondiente Xiangqian Kong, investigador principal del Instituto de Biomedicina y Salud de Guangzhou, de la Academia China de Ciencias.
La nueva estrategia farmacológica es la culminación de una investigación intensiva sobre las formas de atacar y bloquear las proteínas que facilitan los cambios epigenéticos específicos del cáncer en las células. La epigenética («por encima de» la genética) se refiere a las modificaciones químicas del genoma que no cambian la secuencia de ADN. Si el ADN es el hardware de una célula, el epigenoma es el software. Los cambios epigenéticos del ADN, que incluyen la unión o eliminación de grupos metilo, dictan cuándo y dónde se activan o desactivan ciertos genes, y en qué grado.
Así como las anomalías en el ADN pueden provocar cáncer, también lo pueden hacer las anomalías en el epigenoma. Durante la última década, los científicos han desarrollado numerosas terapias que bloquean la metilación anormal del ADN para ayudar a prevenir la progresión del cáncer y la metástasis. En la actualidad, las terapias epigenéticas están aprobadas para los cánceres de la sangre, como la leucemia, pero no para los tumores sólidos.
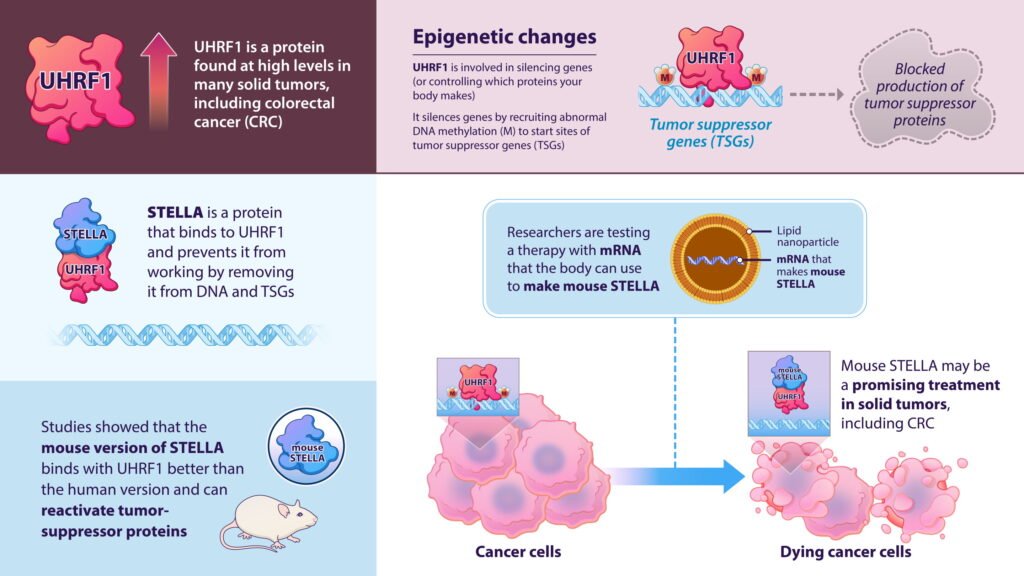
Un objetivo epigenético importante es la UHRF1, una proteína que se expresa en gran medida en muchos tumores sólidos. La UHRF1 actúa como una guía que recluta a otra proteína para agregar grupos metilo al ADN de los genes supresores de tumores. Si los investigadores logran interceptar esa guía, podrían prevenir o incluso deshacer los cambios que causan cáncer en el genoma, afirmaron Baylin y Kong.
Desde 2014, cada vez hay más pruebas que sugieren que STELLA, una proteína que interviene en el desarrollo de embriones de ratón, captura la UHRF1 y la secuestra. Con ese conocimiento, Baylin, Kong y sus colegas se propusieron investigar cómo y por qué STELLA inhibe la UHRF1.
Rápidamente identificaron una diferencia en la actividad de la versión de ratón de la proteína y su contraparte humana: la STELLA de ratón (mSTELLA), pero no la STELLA humana (hSTELLA), se une fuertemente a UHRF1. Al comparar las dos proteínas, descubrieron que mSTELLA y hSTELLA son solo un 31% idénticas a nivel de aminoácidos.
A continuación, el equipo realizó estudios estructurales e identificó una pequeña región peptídica que explicaba la diferencia de actividad entre mSTELLA y hSTELLA. Pero, ¿funcionaría el péptido de ratón tan bien en células cancerosas humanas? Al ponerlo a prueba, los investigadores descubrieron que el péptido mSTELLA era necesario para bloquear eficazmente el UHRF1 y activar los genes supresores de tumores en células de cáncer colorrectal humano .
Basándose en esos resultados, el equipo se puso inmediatamente a desarrollar una estrategia farmacológica utilizando mSTELLA para tratar el cáncer. Diseñaron una terapia con nanopartículas lipídicas (un vehículo de administración de fármacos ultrapequeño hecho de moléculas grasas) para administrar el péptido mSTELLA como ARNm a las células (de manera similar a cómo funcionan la mayoría de las vacunas contra la COVID-19). La terapia funcionó bien en ratones, activando genes supresores de tumores y afectando el crecimiento del tumor.
«Dado que el UHFR1 está implicado como oncogén en numerosos tipos de cáncer, los resultados tienen implicaciones para el tratamiento de muchos cánceres. Estamos muy entusiasmados por avanzar con este estudio para aplicarlo a los pacientes», concluyeron los autores.