Desarrollar nuevos medicamentos que sigan siendo potentes contra las variantes emergentes de COVID-19 es esencial para detener la propagación de la enfermedad altamente contagiosa y proteger la salud humana.
Después de más de dos años de estudiar el SARS-CoV-2, el virus que causa el COVID-19, los investigadores del Laboratorio Nacional de Oak Ridge (ORNL) del Departamento de Energía (DOE) ahora están diseñando y probando antivirales de molécula pequeña que bloquean la capacidad del virus de reproducirse.
Junto con sus colaboradores en el Institut Laue-Langevin (ILL), Francia, los investigadores demostraron que sus moléculas antivirales son tan efectivas como algunos de los medicamentos líderes en el mercado actual.
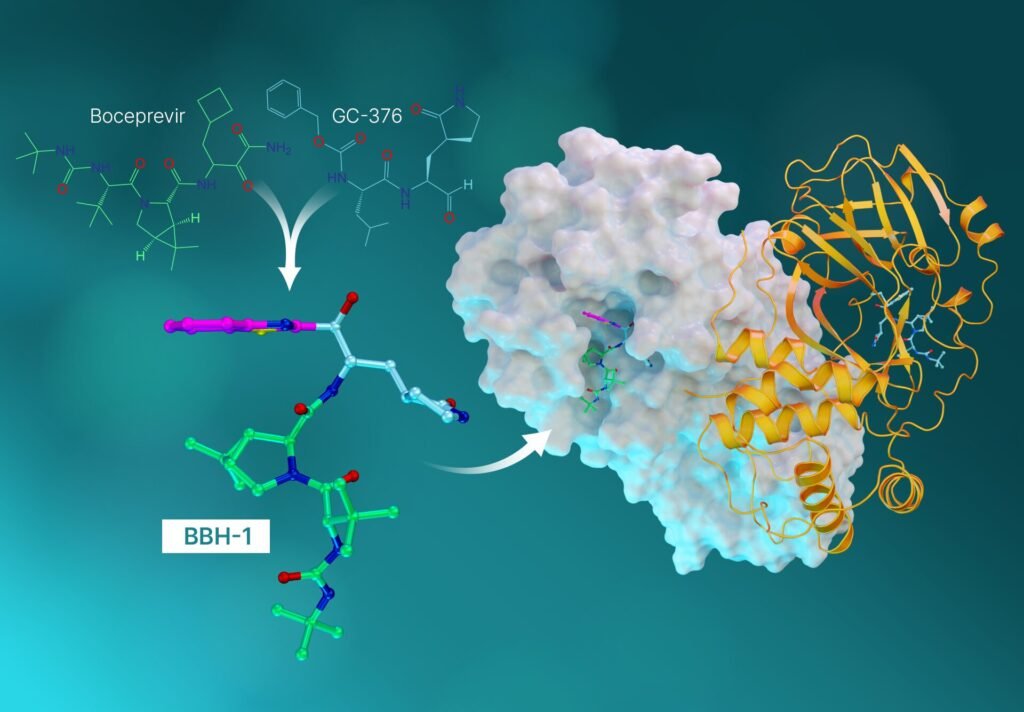
Las moléculas antivirales, llamadas inhibidores híbridos, están hechas de medicamentos reutilizados que se usan para tratar la hepatitis C y el SARS-CoV (el coronavirus que estalló en 2002).
Los alentadores resultados de la investigación del equipo, publicados en la revista Nature Communications, indican que las nuevas moléculas antivirales merecen un mayor desarrollo para su uso potencial como nuevos medicamentos para tratar diversas formas del virus.
«Desde el principio, nuestra investigación ha girado en torno a la proteasa principal , que es una enzima dentro del SARS-CoV-2 que permite que el virus se reproduzca. Si apaga la proteasa, apaga el virus», dijo Daniel Kneller, el autor principal del artículo.
La proteasa principal del SARS-CoV-2 tiene forma de corazón de San Valentín. En su superficie hay bolsillos que pueden unir largas cadenas de aminoácidos expresados ??por el virus. La proteasa se encarga de cortar, o dividir, esas cadenas, que es como se reproduce el virus.
Para comprender mejor cómo funciona la proteasa, los investigadores utilizaron una combinación de rayos X y experimentos de neutrones en la fuente de neutrones de espalación (SNS) y el reactor de isótopos de alto flujo (HFIR) de ORNL para crear un mapa tridimensional completo de cada átomo en la proteasa. estructura. A continuación, trazaron la vasta red de enlaces de hidrógeno que mantienen unida a la proteasa.
También trazaron la ubicación de cada bolsillo donde ocurre el proceso de corte y descubrieron que los sitios donde se cortan las cadenas de aminoácidos están cargados eléctricamente. Conocer las cargas eléctricas positivas, negativas y neutras de los sitios de aminoácidos es clave para diseñar moléculas antivirales que se unan estrechamente a la estructura de la proteasa. Cuanto más se unen las moléculas, más eficaces son para detener la proteasa.
Con los datos experimentales en la mano, los investigadores se dedicaron a investigar medicamentos antivirales contra la hepatitis C que podrían rediseñarse o readaptarse para bloquear la proteasa del SARS-CoV-2.
El equipo estudió tres medicamentos contra la hepatitis C aprobados por la Administración Federal de Medicamentos: boceprevir, narlaprevir y telaprevir. Los experimentos de dispersión de neutrones revelaron que la proteasa SARS-CoV-2 tiene la capacidad única de cambiar de forma y alterar sus estados de carga eléctrica para adaptarse a cualquier molécula de fármaco que se esté introduciendo. El descubrimiento imprevisto no había sido predicho por simulaciones por computadora y proporcionó otra información clave sobre el diseño de nuevas moléculas de fármacos que se unen específicamente al objetivo.
Poniéndolo todo junto
«Este estudio es la culminación de todo lo que hemos aprendido hasta este momento. En él, tomamos las mejores partes de los medicamentos contra la hepatitis C y creamos tres nuevas moléculas y las probamos en la proteasa del SARS-Cov-2», dijo Kneller.
Cada molécula de fármaco tiene lo que se llama una ojiva que se conecta directamente al sitio del aminoácido donde ocurriría la reacción química natural. Idealmente, cuando la cabeza explosiva se une al sitio del aminoácido, la combinación resultante de la enzima y el inhibidor debería representar fielmente la natural.
«Lo que encontramos en nuestros estudios anteriores es que cuando el telaprevir se une, la ojiva tiene una carga neutra y, en realidad, se aleja del sitio especial de aminoácidos donde las interacciones serían fuertes», dijo el científico principal de ORNL, Andrey Kovalevsky.
«Entonces, esta vez, diseñamos inhibidores híbridos para proporcionar el enlace exacto que necesitábamos para establecer interacciones estrechas entre los inhibidores y la proteasa», comentó.
Esta vez, los experimentos de dispersión de neutrones se realizaron utilizando la línea de luz LADI-DALI en el reactor nuclear ILL para acelerar las mediciones de las interacciones de unión molecular entre los tres inhibidores híbridos y la proteasa SARS-CoV-2. Dado que los neutrones no son destructivos y son muy sensibles a los elementos ligeros como el hidrógeno, proporcionan una poderosa herramienta para estudiar procesos biológicos complejos.
«Los neutrones nos permitieron ver por primera vez estas interacciones de unión muy fuertes que forman las moléculas híbridas con la proteasa. Estas características específicas de su diseño podrían incorporarse en el desarrollo de nuevos fármacos que serían potencialmente más efectivos contra la replicación viral.
«Ninguna otra técnica experimental puede proporcionar este nivel de detalle, que es precisamente lo que se necesita para comprender realmente cómo funcionan estas moléculas», señaló el científico de ILL, Matthew Blakeley.
Investigadores de los Institutos Nacionales de Salud realizaron experimentos adicionales usando cinética enzimática in vitro para estudiar los inhibidores en soluciones de probeta. Estas pruebas también confirmaron fuertes interacciones de unión, que fueron estrechamente comparables con algunos de los principales medicamentos para el COVID-19 que se encuentran actualmente en el mercado.
Las muestras de las moléculas inhibidoras y la proteasa SARS-CoV-2 utilizadas en los experimentos se sintetizaron y desarrollaron en el Centro de Ciencias de Materiales de Nanofase (CNMS) y el Centro de Biología Molecular Estructural de ORNL.
«Hemos demostrado capacidades tremendas en nuestra capacidad para proporcionar conocimientos fundamentales sobre una enfermedad emergente y aplicarlos para acelerar el cronograma para realizar tratamientos efectivos», dijo Kovalevsky.
«Este es un gran paso adelante no solo en la lucha contra el COVID-19, sino que esperamos que nuestra investigación se traduzca en desafíos similares que podamos enfrentar en el futuro», enfatizó.