Los antibióticos se usan comúnmente para tratar infecciones y garantizar la seguridad de los procedimientos quirúrgicos. Sin embargo, su uso excesivo ha llevado a la aparición y propagación de bacterias resistentes, lo que ha dado lugar a una «carrera armamentista» en la que los fármacos cada vez más potentes se están convirtiendo en una necesidad. Dado que la resistencia a los antimicrobianos representa un desafío de atención médica cada vez mayor en todo el mundo, los investigadores del grupo de investigación de Ecología de Sistemas del Centro de Biomedicina de Sistemas de Luxemburgo (LCSB) y el Departamento de Ciencias de la Vida (DLSM) y del grupo de Mecanismos de Enfermedades Moleculares de DLSM exploraron el impacto del tratamiento con antibióticos en la comunidad microbiana que habita en el intestino de los ratones. Sus resultados, publicados recientemente en Nature Communications, destacan que algunas bacterias tienen más probabilidades de adquirir genes de resistencia a los antimicrobianos que otras. Los investigadores también describen los mecanismos clave involucrados en la evolución a corto plazo de la resistencia a los antibióticos dentro del microbioma intestinal.
Estudiando el resistoma intestinal en un modelo murino
El uso de antibióticos tanto en el tratamiento de enfermedades humanas como en la cría de animales ha impulsado la acumulación de resistencia a los antimicrobianos (RAM) en todo el mundo. Muchas bacterias ahora han desarrollado resistencia a varias clases de antibióticos, lo que impide el tratamiento integral de las infecciones y provoca un rápido aumento del número de muertes en todo el mundo.
Una publicación reciente en The Lancet muestra que, en 2019, la carga mundial asociada con las infecciones resistentes a los medicamentos se estimó en aproximadamente 5 millones de muertes, de las cuales la RAM fue la causa directa de alrededor de 1,3 millones de muertes.
«La tendencia actual claramente no es a la baja, con COVID-19 alimentando aún más el problema de la resistencia a los antimicrobianos, dejándonos en el camino de 10 millones de muertes por año para 2050″, detalla el Prof. Paul Wilmes, jefe del grupo de Ecología de Sistemas.
“Es por eso que la AMR se conoce actualmente como la ‘pandemia silenciosa’. Sin embargo, todavía hay mucho que aprender sobre su evolución, escalas de tiempo y transmisión», agregó.
Los investigadores de la Universidad de Luxemburgo utilizaron un modelo de ratón para comprender mejor los mecanismos que dan forma a la progresión de la resistencia a los antimicrobianos. Al tratar a un grupo de ratones con un cóctel de antibióticos de amplio espectro, representativo de los regímenes utilizados en los procedimientos preoperatorios, y al seguir su efecto en su microbioma intestinal a lo largo del tiempo, estudiaron cómo algunas bacterias adquieren genes de resistencia a los antimicrobianos.
«Diseñamos nuestro estudio para comprender en qué etapa se adquieren los genes de resistencia y cómo pueden surgir patógenos resistentes después de un solo tratamiento con antibióticos», explicó la Dra. Laura de Nies, investigadora postdoctoral en el grupo de Ecología de Sistemas y coautora principal de la publicación.
Cambios en la composición inducidos por antibióticos
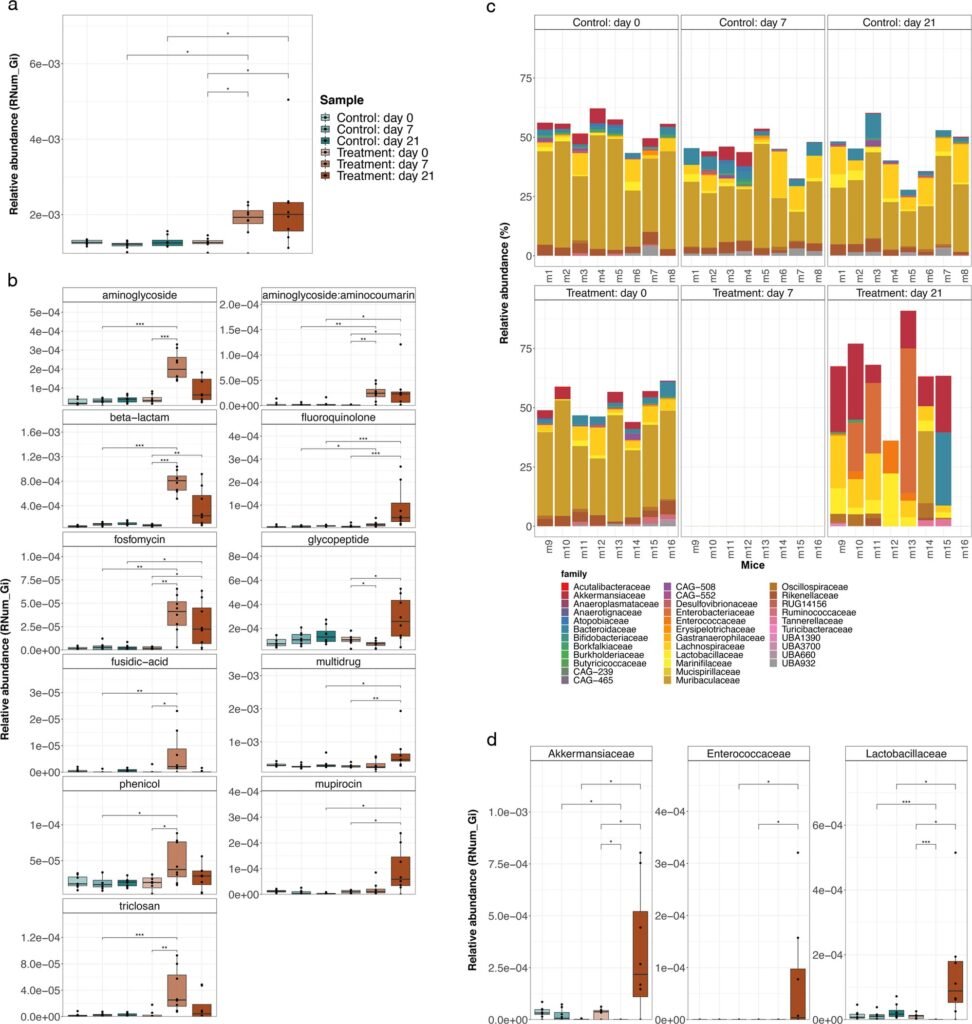
Los investigadores observaron un cambio importante en la composición del microbioma intestinal de los ratones tratados con antibióticos. Si bien la mayoría de las poblaciones bacterianas residentes se agotaron debido al tratamiento, Akkermansia muciniphila y los miembros de las familias Enterobacteriaceae, Enterococcaceae y Lactobacillaceae permanecieron recalcitrantes al tratamiento con antibióticos.
«Curiosamente, ya sabemos que estas bacterias se enriquecen en el intestino de los pacientes con enfermedad de Parkinson y están asociadas con otras enfermedades crónicas», agregó la Dra. Elisabeth Letellier, jefa del grupo de Mecanismos de Enfermedades Moleculares.
«El hecho de que sean más resistentes a los antibióticos muestra cuán generalizada puede ser la implicación de la AMR y cuán importante es comprender mejor los mecanismos subyacentes», sostuvo.
Aumento de los genes de resistencia a los antimicrobianos
Además de los cambios en la composición del microbioma intestinal, los científicos también observaron que los ratones tratados con antibióticos exhibían una abundancia significativamente mayor de genes de resistencia a los antimicrobianos. Más específicamente, vieron un aumento en los genes que confieren resistencia contra tres de los cuatro antibióticos administrados y los análisis sugieren que estos genes probablemente se adquirieron con el tiempo en lugar de estar codificados originalmente con el ADN bacteriano.
«Nuestros resultados muestran que la presión selectiva de los antibióticos administrados puede conducir a la evolución en tiempo real de la resistencia antimicrobiana dentro del microbioma intestinal», explicó el Dr. Susheel Bhanu Busi, miembro del grupo de Ecología de Sistemas y coautor principal de la publicación.
La resistencia a los antimicrobianos se propaga a través de elementos genéticos móviles
Ya se sabe que las bacterias pueden desarrollar resistencia antimicrobiana a través de dos mecanismos genéticos distintos, ya sea mutaciones espontáneas o la acumulación y diseminación de genes de resistencia a través de elementos genéticos móviles (MGEs). Estos elementos son un tipo de material genético que se puede transferir de una especie a otra. Promueven la transferencia de genes de resistencia entre poblaciones bacterianas a través de un proceso conocido como transferencia horizontal de genes.
Para comprender mejor el mecanismo que conduce al aumento observado en los genes de resistencia a los antimicrobianos en los ratones tratados con antibióticos, los investigadores investigaron el papel de los MGE. Descubrieron que los integrones, un tipo específico de elemento genético móvil, desempeñaban un papel clave en la mediación de la resistencia a los antibióticos contra el cóctel de antibióticos administrado.
«Los genes de resistencia encontrados en nuestros ratones tratados con antibióticos fueron en su mayoría conferidos por integrones, lo que destaca un mecanismo genético subestimado para la transmisión de la resistencia a los antibióticos», describió el profesor Paul Wilmes.
«Estos resultados arrojan luz sobre los procesos a corto plazo que configuran la composición de las comunidades expuestas a los antibióticos y la evolución de la resistencia a los antimicrobianos», señaló.
Dado que muchos de estos integrones se asociaron con genomas de familias bacterianas recalcitrantes al tratamiento con antibióticos, como Akkermansiaceae y Enterobacteriaceae, estos hallazgos también refuerzan la importancia de ciertos grupos taxonómicos.
«El estudio enfatiza el papel clave de bacterias específicas y, dada la asociación de estas bacterias con algunas enfermedades crónicas , debemos seguir explorando el papel de los integrones para facilitar la resistencia a los antimicrobianos dentro y más allá de este taxón», concluyó el Prof. Wilmes.