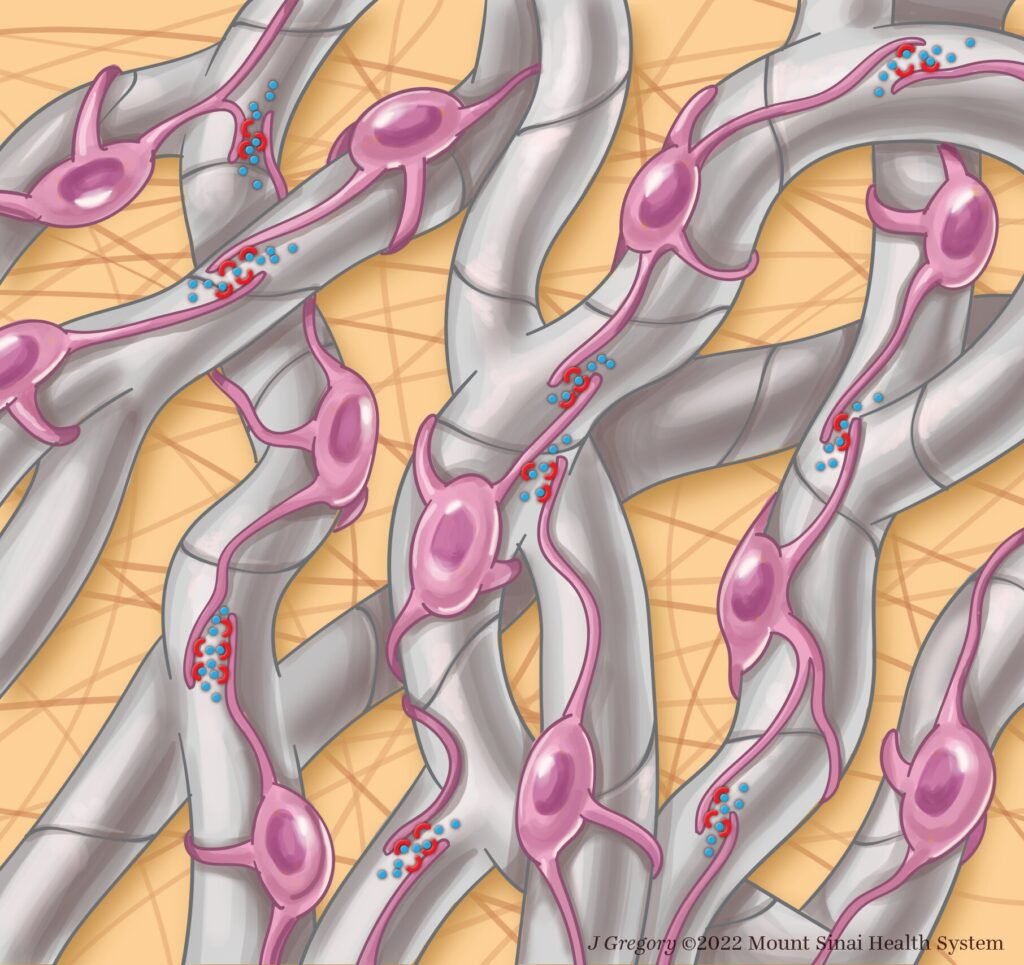
Utilizando las últimas tecnologías, incluida la secuenciación de un solo núcleo de ratones y tejido hepático humano y la imagenología de vidrio 3D avanzada de ratones para caracterizar las células hepáticas clave que producen cicatrices, los investigadores han descubierto nuevos objetivos farmacológicos candidatos para la enfermedad del hígado graso no alcohólico (NAFLD, por sus siglas en inglés).
Utilizando estos métodos innovadores, investigadores de la Escuela de Medicina Icahn en Mount Sinai descubrieron una red de comunicación de célula a célula que genera cicatrices a medida que avanza la enfermedad hepática. Los hallazgos, publicados en línea el 4 de enero en Science Translational Medicine, podrían conducir a nuevos tratamientos.
Caracterizado por grasa en el hígado y a menudo asociado con diabetes tipo 2, hipertensión y lípidos sanguíneos elevados, NAFLD es una amenaza mundial. En los Estados Unidos, se estima que entre el 30 y el 40 % de los adultos se ven afectados, y alrededor del 20 % de estos pacientes tienen una etapa más avanzada llamada esteatohepatitis no alcohólica o NASH (por sus siglas en inglés), que se caracteriza por inflamación del hígado y puede progresar a una cicatrización avanzada (cirrosis) e insuficiencia hepática.
NASH es también la causa de cáncer de hígado de más rápido crecimiento en todo el mundo. Dado que las etapas avanzadas de NASH son causadas por la acumulación de fibrosis o cicatrización, los intentos de bloquear la fibrosis están en el centro de los esfuerzos para tratar NASH, pero actualmente no hay medicamentos aprobados para este propósito, dicen los investigadores.
Como parte de los experimentos, los investigadores realizaron secuenciación de un solo núcleo en estudios paralelos de modelos de ratón con NASH y tejido hepático humano de nueve sujetos con NASH y dos controles. Identificaron un número compartido de 68 pares de posibles objetivos farmacológicos en las dos especies. Además, los investigadores buscaron a uno de estos pares al probar un medicamento contra el cáncer existente en ratones como prueba de concepto.
«Nuestro objetivo era comprender la base de esta cicatrización fibrótica e identificar objetivos farmacológicos que pudieran conducir a nuevos tratamientos para la EHNA avanzada mediante el estudio de las células estrelladas hepáticas, que son las células clave en la producción de cicatrices en el hígado», dijo el autor principal del estudio, Scott L. Friedman, Jefe de Enfermedades del Hígado en Icahn Mount Sinai.
«Al combinar este nuevo enfoque de imágenes de hígado de vidrio, un método avanzado de limpieza de tejidos que permite una visión profunda, junto con el análisis de expresión génica en células estrelladas individuales, hemos revelado una comprensión completamente nueva de cómo estas células generan cicatrices a medida que NASH avanza a etapas tardías», afirmó.
Los investigadores descubrieron que en la enfermedad avanzada, las células estrelladas desarrollan una densa red, o malla, de interacciones entre ellas que facilitan estos 68 pares únicos de interacción no identificados previamente en esta enfermedad.
«Confirmamos la importancia de uno de esos pares de proteínas, NTF3-NTRK3, usando una molécula ya desarrollada para bloquear NTRK3 en cánceres humanos y la reutilizamos para establecer su potencial como un nuevo fármaco para combatir la fibrosis NASH», dijo uno de los autores Shuang Wang, Ph.D., instructor en la División de Enfermedades Hepáticas.
«Esta nueva comprensión del desarrollo de la fibrosis sugiere que la fibrosis avanzada puede tener un repertorio único de señales que aceleran la cicatrización, que representan un conjunto de objetivos farmacológicos previamente no reconocidos», comentó.
Los investigadores plantean la hipótesis de que el circuito de cómo las células se comunican entre sí evoluciona a medida que avanza la enfermedad, por lo que algunos medicamentos pueden ser más efectivos antes y otros en etapas más avanzadas. Y es posible que el mismo medicamento no funcione para todas las etapas de la enfermedad.
Los investigadores están trabajando actualmente con los químicos de Icahn Mount Sinai para optimizar aún más los inhibidores de NTRK3 para el tratamiento de la fibrosis hepática. A continuación, los investigadores planean evaluar funcionalmente a todos los interactores candidatos en un sistema de cultivo celular, seguido de pruebas en modelos preclínicos de enfermedad hepática, como lo han hecho con NTRK3. Además, esperan ampliar sus esfuerzos para determinar si interacciones similares entre las células fibrogénicas subyacen a la fibrosis de otros tejidos, incluidos el corazón, los pulmones y los riñones.
El artículo se titula «Un circuito de señalización autocrino en las células estrelladas hepáticas subyace a la fibrosis avanzada en la esteatohepatitis no alcohólica».