Los científicos de Northwestern Medicine han descubierto un mecanismo por el cual el ejercicio activa los beneficios metabólicos en el cuerpo, según un nuevo estudio publicado en Cell Metabolism.
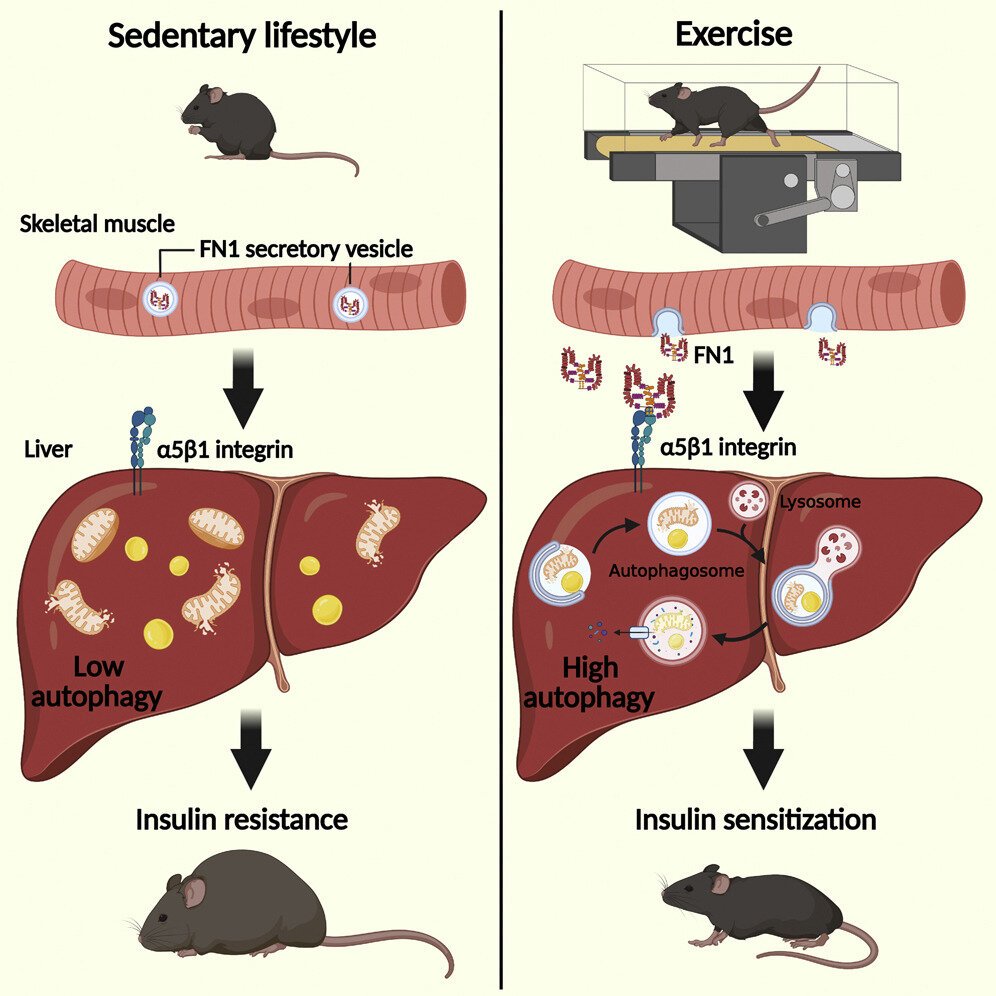
Es bien sabido que el ejercicio genera muchos beneficios para la salud. Sin embargo, aún no se comprende bien cómo se logra esto. Durante el ejercicio, la autofagia, el sistema de reciclaje celular del cuerpo que permite descomponer las estructuras celulares viejas o dañadas, se activa tanto en los músculos que se contraen como en varios órganos que no se contraen, como el hígado.
En el estudio, los investigadores realizaron análisis proteómicos en la sangre de ratones antes y después del ejercicio. Identificaron una proteína secretada por el músculo en contracción, FN1, que aumentó significativamente en el plasma y el suero de los ratones después del ejercicio.
Luego, los científicos analizaron cómo FN1 se comunica con el hígado. Encontraron que las señales FN1 a través de la integrina a5b1, un receptor de membrana en el hígado, inducen la autofagia y provocan los beneficios metabólicos del ejercicio. Además, los investigadores encontraron que los ratones que carecían del gen FN1 en el músculo desarrollaron resistencia a la insulina a pesar del ejercicio diario, según el estudio.
Los hallazgos ayudan a comprender el ejercicio y cómo beneficia el metabolismo, dijo Congcong He, Ph.D., profesor asistente de Biología Celular y del Desarrollo y autor principal del estudio.
«Queríamos entender la autofagia inducida por el ejercicio físico , especialmente en tejidos no contráctiles como el hígado», dijo He, quien también es miembro del Centro Oncológico Integral Robert H. Lurie de la Universidad Northwestern.
«Esto no solo se suma a nuestra comprensión del mecanismo subyacente de cómo el ejercicio induce beneficios metabólicos a nivel sistémico, sino también de cómo las secreciones del músculo se comunican con el hígado. Ahora hemos identificado a FN1 como un mediador de los beneficios inducidos por el ejercicio a través del músculo-hígado comunicación sobre la autofagia”, explicó.
En el futuro, He y sus colaboradores esperan analizar más a fondo FN1 para comprender qué elementos de la proteína activan los beneficios metabólicos después del ejercicio.
«La proteína es bastante grande, por lo que esperamos cortarla en péptidos más pequeños para ver cuáles son bioactivos», dijo agregando que quizás a partir de eso, “podamos desarrollar esto como una inyección para que las personas que no pueden hacer ejercicio aún obtengan los beneficios metabólicos. Por ejemplo, usar esta molécula como un tratamiento de sensibilización a la insulina».